研 究
パーキンソン病関連疾患研究チーム(PDチーム)

(後方)石山駿、佐藤一輝、中村貴彬(宮城病院)、渡部聡
(前方)宮田杏子、菅野直人*、
(加えて)吉田隼(米沢病院)
(*チームリーダー)
大学院入学を希望される皆さんへ
生命活動を維持する環境はほぼ不可算といえるほどの多次元の物質の動きによって形成されています。分子生物学はその中から限られた次元を抽出し、かつ関心物質の作用を拡大することによって研究する手法であり、これは単一遺伝子の障害に起因する疾患の病態研究において偉大な効力を発揮してきました。しかしながら、パーキンソン病の分子病態をごく限られた関心物質の異常で説明することは困難であり、より多次元でのイベントを念頭におく必要があります。そのため、多次元を扱うインフォマティクスと次元に焦点を絞った分子生物学を組み合わせた研究手法を当グループではとることとしています。このようなアプローチは研究の普遍性を高めるのみならず、様々なライフスタイルにあわせた実験計画を提案することを可能としており、興味を持っていただける皆さまを歓迎いたします。
- 課題1. α-synucleinによるエピゲノム制御の解析
α-synucleinはパーキンソン病の病理学的特徴であるレビー小体の主要構成成分であるのみならず、α-synucleinをコードするSNCA遺伝子の点変異 (PARK1)および重複 (PARK4)が家族性パーキンソニズムの原因となることから、パーキンソン病病態の中核として位置づけられています。synucleinの名前は、ゴマフシビレエイ発電器官の神経前終末と核に局在するタンパクとして同定されたことに由来します (synapse+nucleus -> synuclein)が、私たちはこのうちα-synucleinの核での役割を解明すべく研究をすすめています。知られているとおり、核は遺伝子情報を格納したDNAが存在する場所です。細胞はそれら遺伝子の発現の程度によって特徴が決定されますし、おかれた環境へ対応するために発現遺伝子を変化させることによって対応します。この現象はエピゲノム制御と呼ばれ生命現象の根幹のひとつとなります。たとえば神経細胞がドパミンを作ることができなくなっても、ドパミン生合成に関わる遺伝子は核内に存在します。このことはエピゲノム環境を変化することによって、再度ドパミンを産生可能な細胞に戻せる可能性があることを示唆します。このような発想は創薬の面からも魅力的であり、治療標的として期待されます。
エピゲノムは、DNAのメチル化、ヒストン修飾、RNA代謝といった複数の重要な段階によって制御されています。私たちは、この中で特にヒストン修飾に着目しており、α-synucleinがいくつかのヒストン修飾に影響を与えることをこれまでに発表してきました。直近の検討では、- α-synucleinが核内で相互作用を持つタンパクを質量分析で網羅解析し、インフォマティクス解析によってもっとも強く関連するクラスタを選定し、
- 該当クラスタに含まれるBAF複合体とPRMT5によって生じるイベントを分子生物学的手法によって検討しました。
PRMT5はヒストン修飾酵素であり、α-synuclein存在下ではPRMT5によってもたらされるヒストン修飾 (H4R3me2s)が増強されました。PRMT5は、血液系悪性疾患や脳腫瘍の分野では治療標的として開発がすすんでおり、そういったPRMT5阻害薬がパーキンソン病の疾患修飾薬として、ドラッグ・リポジショニングの対象となる可能性も期待されます。
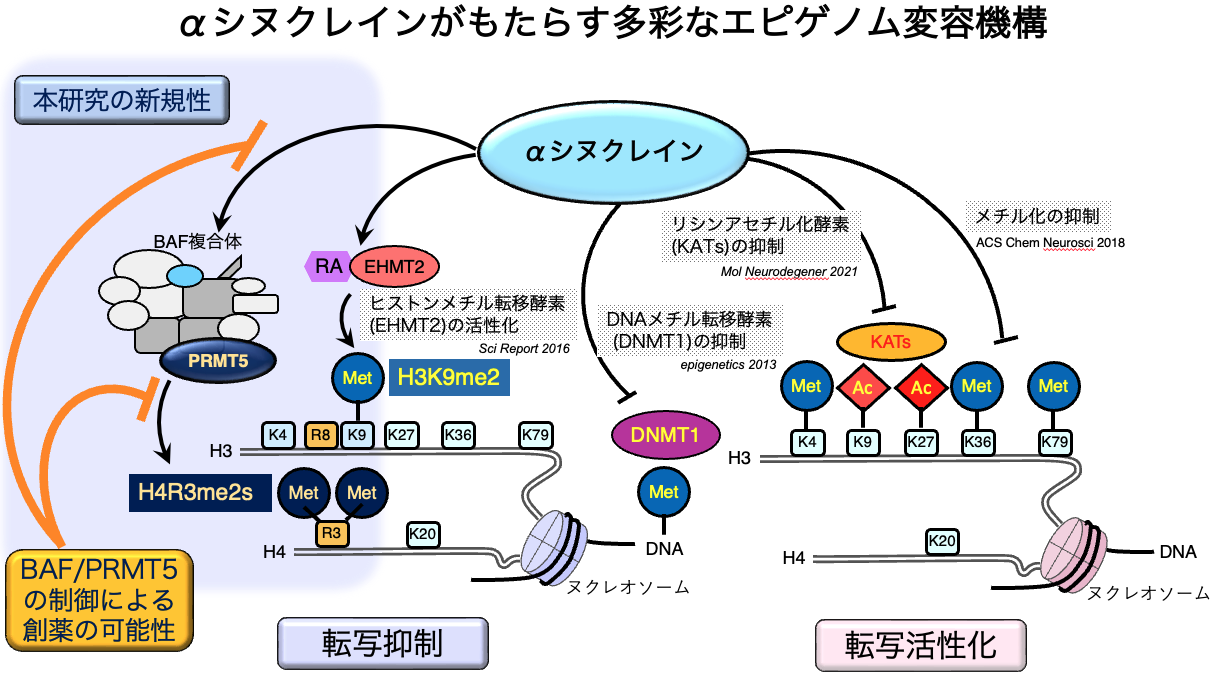
図1. αシヌクレインがもたらす多彩なエピゲノム変容機構
これまで、海外及びおよび本研究室での検討によりαシヌクレインがもたらすエピゲノム変容機構が複数報告されてきました。この研究はαシヌクレインと直接結合する核タンパク質を出発点とした最初の報告であり、BAF複合体-PRMT5によるヒストン修飾(H4R3me2s)を初はじめてあきらかにしています。
プレスリリース:https://www.tohoku.ac.jp/japanese/2024/01/press20240109-03-parkinson.html- 課題2. 遺伝性ジストニアDYT-KMT2Bの早期スクリーニング法の開発
- 研究の背景
遺伝性ジストニアDYT-KMT2BはKMT2Bの遺伝子異常によってもたらされ、DYT28とも呼ばれる疾患です。遺伝性ジストニアの頻度は10万人あたり16人とされ、その中で単一遺伝子の異常が検出されたのが19%であり、その内訳としてもっとも頻度が高い(9%)のがDYT-KMT2Bです(Zech M., et al. Lancet Neurology 2020)。KMT2Bはリシンメチル基転移酵素であり、その代表的な基質はヒストンH3タンパクです。その産物はH3K4me3と呼ばれ、エピゲノム制御において重要な役割を果たします。H3K4me3は生命活動の至る所で重要であることから、その程度は多くの因子によって制御されています。事実、H3K4を基質とするメチル転移酵素は6種存在し、H3K4me3がどのメチル転移酵素を主として用いているかは細胞種によって異なります。直近の研究では、
- H3K4を基質とするメチル転移酵素の細胞種毎の発現をインフォマティクス解析したところ、KMT2Bは口腔粘膜に高発現していることがわかり、
- KMT2Bによって触媒されるH3K4me3を口腔粘膜由来サンプルで検討したところ、DYT-KMT2Bで有意な低下が観察されました。
口腔粘膜を用いた検査はDYT-KMT2Bの補助診断として有用となる可能性があり、現在検査の精度を高めるための検討を行っています。
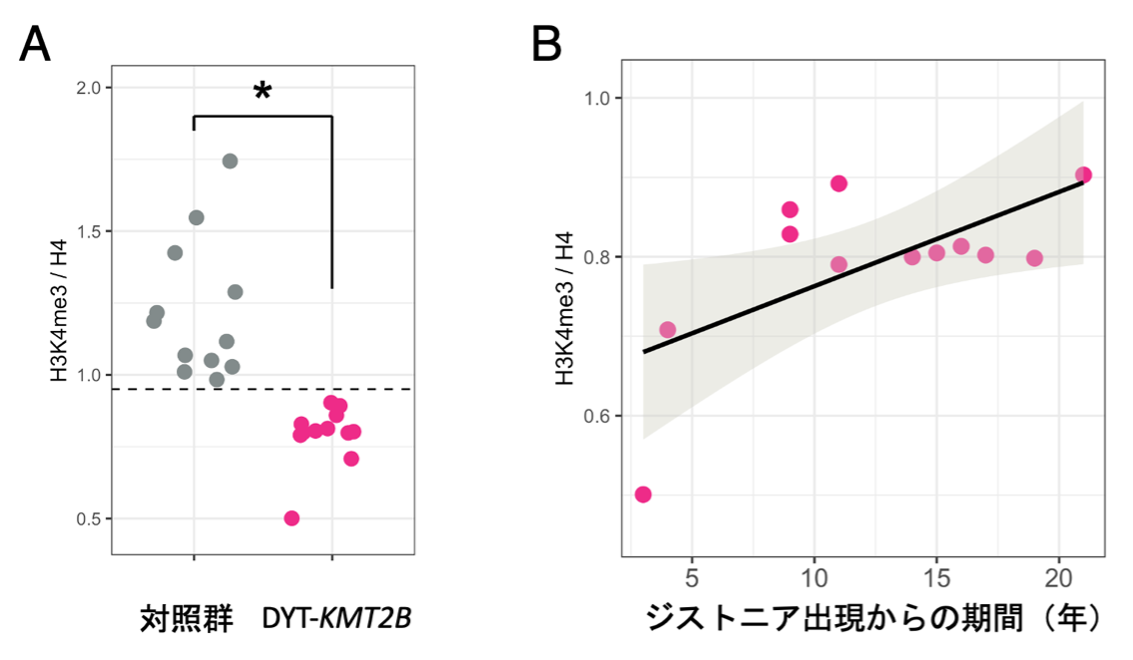
図2. (A)遺伝性ジストニアDYT-KMT2Bでは、対照群に比してH3K4me3の低下がみられました(*:p=0.00004、 H3K4me3は内部標準のH4で補正されています)。(B)H3K4me3の低下は、DYT-KMT2Bの運動症状出現からの期間が短いほどより強くみられました(p=0.03)。
プレスリリース:https://www.tohoku.ac.jp/japanese/2024/06/press20240611-01-mucosa.html - 課題3. α-synucleinの細胞膜受容体の探索
α-synucleinの細胞間伝播はパーキンソン病分子病態における主要な機構のひとつとして位置づけられています。細胞間に存在する凝集α-synucleinはなんらかの形で細胞表面に存在する受容体を介して細胞内に取り込まれると推定されていましたが、これまであきらかではありませんでした。直近の研究では、
- 膜タンパク質ライブラリを用い、凝集α-synucleinと会合するタンパクを質量分析で解析し、いくつかの候補タンパクを得ました。
- 候補タンパクを共免疫沈降法で絞り込んだところ、sortilinタンパクが凝集α-synuclein受容体であることを確認しました。
このことは、パーキンソン病の病態進展の基盤機構の一端をあきらかにしたのみならず、凝集α-synucleinの細胞間伝播を抑制するうえでの標的として期待されます。
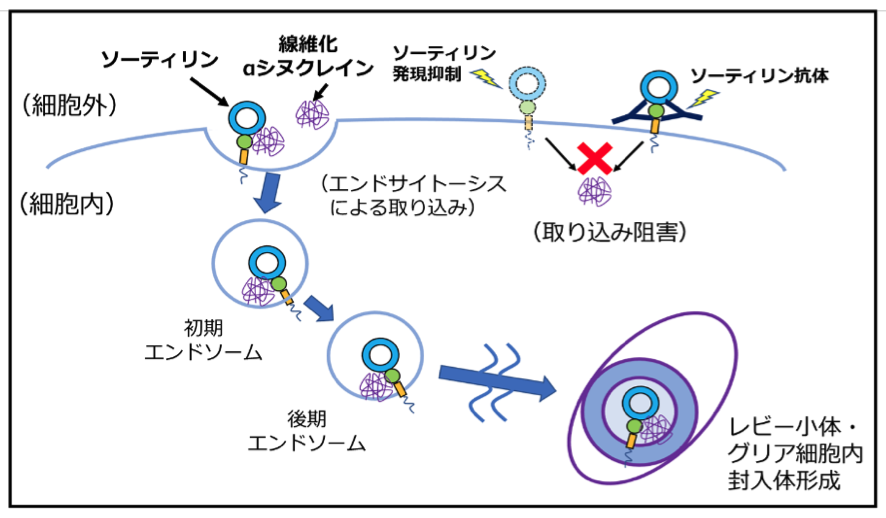
図 3. ソーティリンを介した凝集αシヌクレインの輸送・蓄積
ソーティリンと供に細胞内へ取り込まれた細胞外の凝集αシヌクレインは、初期・後期エンドソームに運搬され蓄積し、パーキンソン病および類縁疾患である多系統萎縮症患者脳内のαシヌクレイン陽性封入体形成に関与する。凝集αシヌクレインの神経細胞への取り込み・蓄積は、ソーティリン発現抑制・抗ソーティリン抗体投与により抑制される。
プレスリリース:https://www.tohoku.ac.jp/japanese/2023/06/press20230613-02-parkinson.html- 課題4. 遺伝性パーキンソニズムPARK21 (DNAJC13)の病態解明
プレスリリース:https://www.tohoku.ac.jp/japanese/2018/01/press20180117-01.html
- 主な研究業績とリンク(PDチーム)
-
- Sugeno N., Kumada S., Kashii H., et al. Reduced histone H3K4 trimethylation in oral mucosa of patients with DYT-KMT2B. Parkinsonism Relat Disord. 2024; 124: 107018. in press
- Nakamura T., Sugeno N., Hasegawa T., et al. Alpha-synuclein promotes PRMT5-mediated H4R3me2s histone methylation by interacting with the BAF complex. FEBS J. 2024; 291: 1892-1908.
- Sugeno N., Hasegawa T., Haginoya K., et al. Detection of Modified Histones from Oral Mucosa of a Patient with DYT-KMT2B Dystonia. Mol Syndromol. 2023; 14: 461-468.
- Ishiyama S., Hasegawa T., Sugeno N, et al. Sortilin acts as an endocytic receptor for α-synuclein fibril. FASEB J. 2023; 37: e23017.
- Sugeno N., Hasegawa T. Unraveling the Complex Interplay between Alpha-Synuclein and Epigenetic Modification. Int J Mol Sci. 2023; 24: 6645.
- Yoshida S., Hasegawa T. Beware of Misdelivery: Multifaceted Role of Retromer Transport in Neurodegenerative Diseases. Front Aging Neurosci. 2022; 14: 897688.
- Yoshida S., Hasegawa T. Deciphering the prion-like behavior of pathogenic protein aggregates in neurodegenerative diseases. Neurochem Int. 2022; 155: 105307.
- Kobayashi J., Hasegawa T., Sugeno N., et al. Extracellular α-synuclein enters dopaminergic cells by modulating flotillin-1-assisted dopamine transporter endocytosis. FASEB J. 2019 33: 10240-10256.
- Yoshida S., Hasegawa T., Suzuki M., et al. Parkinson’s disease-linked DNAJC13 mutation aggravates α-synuclein-induced neurotoxicity through perturbation of endosomal trafficking. Hum Mol Genet. 2018; 27, 823-836.
- Hasegawa T., Yoshida S., Sugeno N., et al. DnaJ/Hsp40 family and Parkinson’s disease. Front Neurosci. 2018; 11, 743.
- Sugeno N., Jackel S., Voigt A., et al., α-Synuclein enhances histone H3 lysine-9 dimethylation and H3K9me2-dependent transcriptional responses. Sci Rep. 2016; 6, 36328.
