

ニュース
ALSに対するHGFによる第1相臨床試験が治験審査委員会にて承認されました
2011/07/21
この第1相試験は、薬剤の安全性と薬物動態(体内での薬剤の動き)を確かめることが目的です。したがって、病気に対する治療効果が期待できるものではありません。第1相試験で安全性がきちんと確認できた後、新たに治療効果を確認するための試験(第2相・第3相試験)を計画する予定です。
平成23年7月11日に東北大学治験審査委員会(IRB)が行われ、「ALS患者を対象としてSM-1500を用いてKP-100ITを脊髄腔内投与したときの安全性、忍容性および薬物動態を検討する第1相試験」の申請について治験の実施が承認されました。
今後、具体的な手順について東北大学病院治験センター、TRセンターと協力しつつ準備をすすめ治験を開始する予定です。
治験に関するお問い合わせは現在専用FAX:022-728-3455でのみ承ります。大変申し訳ございませんが、電話やメールでのお問い合わせには対応しておりませんのでご了承ください。治験にご協力くださる患者さんに関しては、主治医の先生からFAXでお問い合せいただいた場合に限り、対応させていただきます。
治験における患者さんの選択基準、治験デザイン(投与方法、量、人数、期間)、併用薬その他の除外基準を掲載いたします。第1相試験のため選択基準がやや厳しくなっておりますが、主治医の先生にはご参考としていただければ幸いです。
治験デザイン
脊髄腔内単回投与
登録基準を満たすALS患者を被験者とし、0.2mg、0.6mgおよび2.0mgの各用量にてHGFの単回脊髄腔内投与を行う(各用量3例)。脊髄腔内投与のための投与ルートとして、脊髄腔内に専用のカテーテルを挿入する。脊髄腔内カテーテルには皮下埋め込みポートを接続し、皮下ポートを介してHGFを投与する。最低用量の0.2mgから投与を開始する。脊髄腔内カテーテル/皮下ポートを埋め込んだまま、投与後36日まで経過観察を行い、有害事象のモニタリングを行うとともにHGFの薬物動態を評価する。投与の36日目に脊髄腔内カテーテル/皮下ポートを抜去し、さらに7日間(+3日以内)の観察を行う。0.2mgの投与群(3例)が終了した後、用量を0.6mg、ついで2.0mgの投与群を開始する。
脊髄腔内反復投与
単回投与において、3例全例で安全性および忍容性を確認できた投与群のうちの最高用量(または効果安全性評価委員会での審議によって決定された用量)で、1週間に1回の投与間隔で計5回の反復脊髄腔内投与を行うこととする(単回投与と重複しない3例)。5回目の投与の後、単回投与の場合と同様に脊髄腔内カテーテル/皮下ポートを埋め込んだまま、最終投与の36日目(最初の投与から64日目)まで経過観察を行い、有害事象のモニタリングを行うとともにHGFの薬物動態を評価する。最終投与の36日目(最初の投与から64日目)に脊髄腔内カテーテル/皮下ポートを抜去し、さらに7日間(+3日以内)の観察を行う(図)。
図. 治験デザインの概略
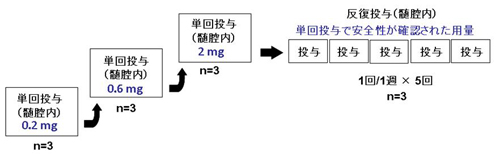
予定症例数、治験参加期間
本治験では、実施施設数、使用可能設備、実施可能被験者数、治験実施期間に基づき、適格例として、各投与群3例、計12例(単回投与9例、反復投与3例)の被験者が必要となる。単回投与では1症例の治験参加期間は約50日(入院期間: 約3週間)、反復投与では1症例の治験参加期間は約80日(入院期間: 約7週間)である。単回投与において一用量群あたりの治験期間は約2.5ヶ月、3用量群を終了するまでの期間は約10ヶ月、反復投与群の治験期間は約7ヶ月と見込まれ、全体の治験期間は約17ヶ月と予想される。
治験登録、選択基準
被験者背景
本治験では、発症後2年以内のALS患者であって、ALSの重症度分類(添付B参照)が1もしくは2の患者を対象とする。
治験責任医師または治験分担医師は、各々の症例に対し、脊髄腔内カテーテル/皮下ポートの埋込み手術を行う前に、治験への登録基準として以下の選択基準を満たしており、かつ除外基準のいずれにも抵触しないことを確認する。
選択基準
同意取得日に、以下のすべての基準を満たすことを確認する。
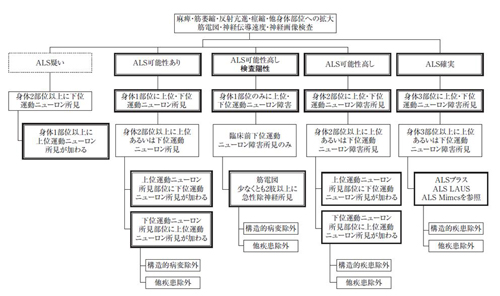
1.ALSの診断基準(世界神経学会El Escorial改訂;添付A)における「ALS可能性高し 検査陽性」、「ALS可能性高し」または「ALS確実」に該当し、発症後2年以内である患者
2.ALSの重症度分類(添付B)が1もしくは2である患者
3.年齢が20歳以上、65歳未満である患者
4.単回投与の場合、カテーテルの埋込の前日より少なくともHGF投与15日目検査日(反復投与の場合には43日目検査日)までの入院が可能な患者
5.治験参加について本人から文書にて同意が得られている患者
除外基準
以下の除外基準のいずれにも抵触しないことを確認する。
1.重篤な肝障害、腎障害、心疾患、肺疾患、血液疾患、代謝疾患等の疾患を有し、治験責任医師または治験分担医師が治験の対象には不適切であると判断した患者
2.ヘモグロビンA1c(JDS値)が6.1%以上の患者
3.登録前1ヶ月以内に、医薬品・医療機器の治験もしくは研究に参加した患者
4.安全性に影響を及ぼす下記疾患または症状を有している患者
5.悪性新生物、脊髄腔内感染症、脊髄腔内の腫瘤、増殖性網膜症、呼吸機能の明らかな低下が認められる患者(スパイログラムにおける%肺活量が70%未満)
6.がんの既往歴のある患者
7.薬物アレルギーのある患者
8.抗生物質に対しアレルギー反応を有する患者および器具移植に対し以前に不耐性を示した患者
9.脊髄腔内カテーテル/皮下ポートに含まれるチタン合金、ポリスルホン、ポリプロピレン、ポリウレタン、シリコーンゴム、ステンレス鋼等の材質にアレルギー反応を示す患者、およびそれらの疑いを有する患者
10.解剖学的にカテーテルを挿入する事が困難な患者
11.脊髄・脊椎にALS以外の異常があってこの治験実施が困難な患者、カテーテルの埋め込みや薬剤注入により悪化する可能性がある患者
12.全身治療を要する感染症あるいは髄膜炎、敗血症、菌血症、腹膜炎および皮膚伝染性疾患を有する患者、およびそれらの疑いを有する患者
13.出血性素因等を有する患者
14.血栓凝固線溶障害あるいは何らかの要因による凝固線溶能の重篤な変化を有する患者、あるいは抗凝固薬・抗血小板薬を服用中の患者
15.認知症と診断されている患者
16.精神病または精神症状を有しており、治験への参加が困難と判断される患者
17.女性で妊娠中または妊娠の疑いがある患者、妊娠を希望する患者、または授乳中の患者
18.その他、治験責任医師または治験分担医師が不適当と判断した場合
添付 A
筋萎縮性側索硬化症の診断基準
(世界神経学会El Escorial改訂)
添付 B
筋萎縮性側索硬化症の重症度分類
(厚生労働省 特定疾患研究調査 2007.1.1)
1. 家事・就労はおおむね可能
2. 家事・就労は困難だが、日常生活(身の回りのこと)はおおむね自立
3. 自力で食事、排泄、移動のいずれか一つ以上ができず、日常生活に介助を要する
4. 呼吸困難・痰の喀出困難、あるいは嚥下障害がある
5. 気管切開、非経口的栄養摂取(経管栄養、中心静脈栄養など)、人工呼吸器使用
併用薬およびその他の制限事項
併用薬およびその他の制限事項
治験責任医師は、被験者の薬物療法について事前に情報を入手するとともに、治験実施期間中、併用薬の用法・用量の変更等に注意を払う。
併用可能薬
リルゾール(リルテック錠)は、登録前の投与期間および投与量に関わらず、原則的に用量を変更せずに併用可能とする。また、登録時に4週以上投与を継続している薬物がある場合、同投与量および投与方法で投与を継続することができる。
加えて、治験機器の埋め込み時の麻酔薬、および検査・観察に用いる検査薬および治験責任医師または治験分担医師が必要と判断した薬剤(例:手術に伴う抗生剤)は併用可能とする。
併用禁止薬
脊髄腔内に投与される薬剤についてはすべて併用禁止とする。また、前述の4週間以上継続投与されている薬剤以外の併用は禁止する。ただし、有害事象の処置等やむを得ず使用した場合には、その薬剤名、使用目的、1日量、投与経路、投与開始日および投与終了日を症例報告書に記載する。登録後、4週間以上投与を継続している薬剤でも、やむを得ず投与量および投与方法を変更する必要が生じた場合も同様に記載する。
|
|
| ←新しい記事へ | ↑一覧へ | 以前の記事へ→ |
